Trẻ em dưới 12 tuổi chiếm 15% dân số, Mỹ triển khai tiêm vắc-xin Covid-19 cho nhóm này như thế nào?
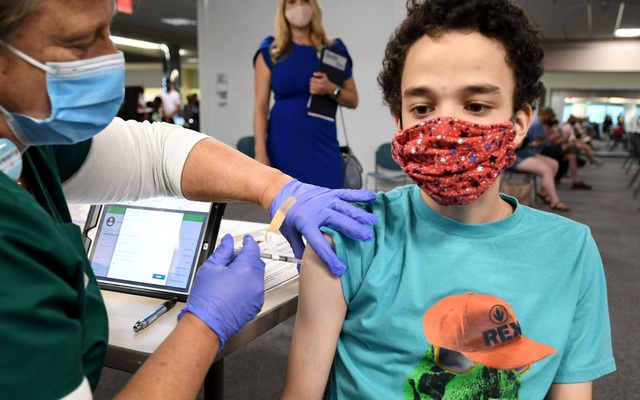
Một trong những trở ngại lớn nhất của Mỹ đối với việc thực hiện chiến dịch tiêm chủng là trẻ em dưới 12 tuổi, chiếm gần 15% dân số tức 48 triệu người, vẫn chưa đủ điều kiện tiêm vắc xin ngừa Covid-19.
- 02-09-2021Trong nửa năm, Mỹ vứt bỏ tới 15 triệu liều vaccine COVID-19
- 02-09-2021WHO theo dõi biến thể Covid-19 mới có tên "MU" với khả năng lẩn tránh kháng thể: Người đã tiêm vắc xin hay từng mắc bệnh đều có nguy cơ nhiễm
- 02-09-2021Bất lực trước biến chủng Delta lây lan, Australia từ bỏ chiến lược “zero Covid”
Theo Viện Hàn lâm Nhi khoa Mỹ, "tính đến ngày 19/8, hơn 4,59 triệu trẻ em đã có kết quả xét nghiệm dương tính với Covid-19 kể từ khi đại dịch bùng phát". Do đó, một câu hỏi lớn trong cuộc đấu tranh của Mỹ chống lại đại dịch Covid-19 là khi nào trẻ em dưới 12 tuổi có thể tiêm phòng?
Mốc thời gian dự kiến của vắc xin dành cho trẻ em dưới 12 tuổi
Cả Pfizer và Moderna đều đã đưa trẻ em vào thử nghiệm lâm sàng vào tháng 3, nhưng kết quả nghiên cứu chưa được công bố.
Pfizer dự kiến sẽ có dữ liệu về hiệu quả của vắc xin đối với trẻ em từ 6-11 tuổi vào cuối tháng 9. Cơ quan Quản lý Thực phẩm và Dược phẩm (FDA) thường mất vài tuần để xem xét các dữ liệu. Vì vậy, nếu kết quả thử nghiệm tốt, Mỹ sẽ bắt đầu tiêm phòng cho trẻ nhỏ sớm nhất vào tháng 10. Trong khi đó, Moderna hy vọng sẽ có dữ liệu về hiệu quả của vắc xin đối với trẻ em vào cuối mùa thu hoặc đầu mùa đông.
Moderna cho biết, có khả năng họ sẽ có dữ liệu cho trẻ từ 6-12 tuổi vào mùa thu năm nay, sau Pfizer khoảng 1-2 tháng. Sau đó, dữ liệu nghiên cứu cho trẻ 6 tháng trở lên sẽ có vào cuối năm 2021 đến đầu năm 2022.
FDA vẫn chưa cấp phép vắc xin Moderna và J&J cho trẻ lớn hơn
FDA đã yêu cầu cả Pfizer và Moderna mở rộng thử nghiệm với trẻ dưới 12 tuổi vào tháng 7, với lý do lo ngại rằng các nghiên cứu không đủ lớn để phát hiện các tác dụng phụ hiếm gặp như đau tim.
Pifzer đã nghiên cứu vắc xin cho hơn 4.500 trẻ nhỏ, được chia thành 2 nhóm tuổi: 5-11 tuổi và 6 tháng – 5 tuổi. Trong khi đó, thử nghiệm của Moderna bao gồm 3 nhóm tuổi: 6-11 tuổi, 2-5 tuổi, 6 tháng- dưới 2 tuổi với 2.265 trẻ mỗi nhóm. Theo tờ New York Times, FDA đã yêu cầu cả hai công ty tăng ít nhất số lượng thử nghiệm lên 3.000 trẻ em trong độ tuổi từ 5-11 tuổi.
FDA đã cho phép tiêm vắc xin của Pfizer cho trẻ em từ 12-15 tuổi vào tháng 5. Nhưng Moderna vẫn đang chờ cấp phép cho vắc xin ngừa Covid-19 với đối tượng 12-17 tuổi.
Johnson & Johnson (J&J) có tiến trình chậm hơn. Cho đến mùa thu năm nay, công ty mới bắt đầu nghiên cứu vắc xin cho trẻ từ 12-17 tuổi. Nếu việc tiêm phòng được chứng minh là an toàn và hiệu quả đối với trẻ lớn, J&J sau đó mới thử nghiệm với trẻ từ 2-11 tuổi và trẻ dưới 2 tuổi.
Trẻ em cần liều lượng thấp hơn
Thử nghiệm giai đoạn 1 của Pfizer chỉ ra rằng liều lượng vắc xin 10 microgam là an toàn cho trẻ từ 5-11 tuổi so với liều lượng bình thường của người lớn là 30 microgam. Pfizer cũng thử nghiệm sử dụng liều lượng thậm chí ít hơn nữa là 3 microgam cho trẻ từ 6 tháng – 5 tuổi.
Tương tự, Moderna cũng cân nhắc giảm liều lượng từ 100 microgam cho người trưởng thành, xuống còn 50 hoặc 100 microgam cho trẻ 2-12 tuổi. Trẻ em từ 6 tháng-2 tuổi sẽ tiêm liều 25, 50 hoặc 100 microgam.
Liều thấp hơn có thể giúp tránh những tác dụng phụ không cần thiết. Trong thử nghiệm của Pfizer, lứa tuổi thanh thiếu niên dường như xuất hiện tác dụng phụ thường xuyên hơn người lớn. Điều đó có thể do hệ thống miễn dịch của trẻ hoạt động nhanh chóng hơn. Nhưng ngay cả các tác dụng phụ thường gặp nhất như mệt mỏi và đau đầu đều không đáng kể.
Vì FDA đã hoàn toàn chấp thuận vắc xin Pfizer cho người từ 16 tuổi, các bác sĩ khoa nhi có thể kê đơn hợp pháp với loại vắc xin này. Nhưng các quan chức y tế khuyến cáo chưa nên tiến hành làm như vậy. Giám đốc Viện Y tế Quốc gia Mỹ Francis Collins cho biết: "Hãy nhớ rằng trẻ em không phải người lớn thu nhỏ. Chúng có hệ thống miễn dịch và trao đối chất khác. Bạn cần phải thực hiện các thử nghiệm cẩn thận để đảm bảo dùng đúng liều lượng và không xảy ra bất trắc".
Tổng hợp
